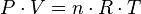Calor Y Temperatura
Temperatura:
La temperatura es una magnitud referida a las nociones comunes de caliente, tibio o frío que puede ser medida
con un termómetro.
Calor:
El calor está definido como la forma de energía que se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa simplemente transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
Diferencia entre Calot Y Temperatura:
Termodinamicamente, la TEMPERATURA es una medida de la energía cinética (velocidad) de las moléculas de una sustancia.
En cambio, el CALOR es una forma de energía en tránsito (movimiento) debido a una diferencia de temperaturas. El calor se transfiere desde los sitios o cuerpos de mayor temperatura hacia los de menor temperatura.Dilatacion:
Se denomina dilatación térmica al aumento de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al aumento de temperatura que se provoca en él por cualquier medio. La contracción térmica es la disminución de propiedades métricas por disminución de la misma.
Dilatacion lineal
El coeficiente de dilatación lineal, designado por αL, para una dimensión lineal cualquiera, se puede medir experimentalmente comparando el valor de dicha magnitud antes y después de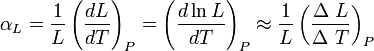 left}} Donde
left}} Donde  , es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura
, es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura 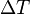 a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:- α=coeficiente de dilatación lineal [°C-1]
- L0 = Longitud inicial
- Lf = Longitud final
- T0 = Temperatura inicial.
- Tf = Temperatura final
Dilatación volumétrica
Es el coeficiente de dilatación volumétrico, designado por αV, se mide experimentalmente comparando el valor del volumen total de un cuerpo antes y después de cierto cambio de temperatura como, y se encuentra que en primera aproximación viene dado por:
Experimentalmente se encuentra que un sólido isótropo tiene un coeficiente de dilatación volumétrico que es aproximadamente tres veces el coeficiente de dilatación lineal. Esto puede probarse a partir de la teoría de la elasticidad lineal. Por ejemplo si se considera un pequeño prisma rectangular (de dimensiones: Lx, Ly y Lz), y se somete a un incremento uniforme de temperatura, el cambio de volumen vendrá dado por el cambio de dimensiones lineales en cada dirección:
Esta última relación prueba que
 , es decir, el coeficiente de dilatación volumétrico es numéricamente unas 3 veces el coeficiente de dilatación lineal de una barra del mismo material.
, es decir, el coeficiente de dilatación volumétrico es numéricamente unas 3 veces el coeficiente de dilatación lineal de una barra del mismo material.
Dilatación de área
Cuando un área o superficie se dilata, lo hace incrementando sus dimensiones en la misma proporción. Por ejemplo, una lámina metálica aumenta su largo y ancho, lo que significa un incremento de área. La dilatación de área se diferencia de la dilatación lineal porque implica un incremento de área.
El coeficiente de dilatación de área es el incremento de área que experimenta un cuerpo de determinada sustancia, de área igual a la unidad, al elevarse su temperatura un grado centígrado. Este coeficiente se representa con la letra griega gamma (γ). El coeficiente de dilatación de área se usa para los sólidos. Si se conoce el coeficiente de dilatación lineal de un sólido, su coeficiente de dilatación de área será dos veces mayor:
Al conocer el coeficiente de dilatación de área de un cuerpo sólido se puede calcular el área final que tendrá al variar su temperatura con la siguiente expresión:
Donde:![A_f = A_0 [1 +\gamma_A (T_f - T_0)]\;](http://upload.wikimedia.org/math/8/4/4/84444b9c6e865aaf0b6d1376be7a9a6b.png)
- γ=coeficiente de dilatación de área [°C-1]
- A0 = Área inicial
- Af = Área final
- T0 = Temperatura inicial.
- Tf = Temperatura final
Cambio de Estado
- En física y química se denomina cambio de estado la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en nuestro universo es el plasma, material del que están compuestas las estrellas (si descartamos la materia oscura).
Cambios de estado de agregación de la materia
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotermico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Cuando dichas moléculas se moverán en una forma independiente, transformándose en un líquido.
Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporación. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
-
Fluidos
Se denomina fluido a un tipo de medio continuo formado por alguna sustancia entre cuyas moléculas hay una fuerza de atracción débil.
Características
- Movimiento no acotado de las moléculas. Son infinitamente deformables, los desplazamientos que un punto material o molécula puede alcanzar en el seno del fluido no están acotados (esto contrasta con los sólidos deformables, donde los desplazamientos están mucho más limitados). Esto se debe a que sus moléculas no tienen una posición de equilibrio, como sucede en los sólidos donde la mayoría de moléculas ejecutan pequeños movimientos alrededor de sus posiciones de equilibrio.
- Compresibilidad. Todos los fluidos son compresibles en cierto grado. No obstante, los líquidos son altamente incompresibles a diferencia de los gases que son altamente compresibles. Sin embargo, la compresibilidad no diferencia a los fluidos de los sólidos, ya que la compresibilidad de los sólidos es similar a la de los líquidos.
- Viscosidad, aunque la viscosidad en los gases es mucho menor que en los líquidos. La viscosidad hace que la velocidad de deformación puede aumentar las tensiones en el seno del medio continuo. Esta propiedad acerca a los fluidos viscosos a los sólidos viscoelásticos.
- Distancia Molecular Grande: Esta es unas características de los fluidos la cual sus moléculas se encuentran separadas a una gran distancia en comparación con los sólidos y esto le permite cambiar muy fácilmente su velocidad debido a fuerzas externas y facilita su compresión.
- Fuerzas de Van der Waals: Esta fuerza fue descubierta por el físico holandés Johannes Van der Waals, el físico encontró la importancia de considerar el volumen de las moléculas y las fuerzas intermoleculares y en la distribución de cargas positivas y negativas en las moléculas estableciendo la relación entre presión, volumen, y temperatura de los fluidos.
- Ausencia de memoria de forma, es decir, toman las forma del recipiente que lo contenga, sin que existan fuerzas de recuperación elástica como en los sólidos. Debido a su separación molecular los fluidos no poseen una forma definida por tanto no se puede calcular su volumen o densidad a simple vista, para esto se introduce el fluido en un recipiente en el cual toma su forma y así podemos calcular su volumen y densidad, esto facilita su estudio. Esta última propiedad es la que diferencia más claramente a fluidos (líquidos y gases) de sólidos deformables.
Ley de los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es: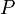 = Presión absoluta
= Presión absoluta = Volumen
= Volumen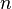 = Moles de gas
= Moles de gas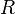 = Constante universal de los gases ideales
= Constante universal de los gases ideales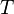 = Temperatura absoluta
= Temperatura absoluta
Ley de Boyle-Mariotte
Leyes de Charles y Gay-Lussac
En 1802, Louis Gay Lussac publica los resultados de sus experimentos, basados en los que Jacques Charles hizo en el 1787. Se considera así al proceso isobárico para la Ley de Charles, y al isocoro (o isostérico) para la ley de Gay Lussac.Proceso isobaro (Charles)
Proceso isocoro ( Gay Lussac)
Ley de Avogadro
El volumen que ocupa un mol de cualquier gas ideal a una temperatura y presión dadas siempre es el mismo.

![L_f = L_0 [1 +\alpha_L (T_f - T_0)]\;](http://upload.wikimedia.org/math/4/d/8/4d8d9e521d59aa36de0d776706db3b16.png)